肺高血圧症の病態の解明、診断能と治療成績の向上、および治療指針の確立をはかり、貢献することを目的として活動を行っております
本学会について
2022年度 日本肺高血圧・肺循環学会「八巻賞」受賞者
2022年度 日本肺高血圧・肺循環学会「八巻賞」受賞者および受賞研究題目
●中岡 良和(国立循環器病研究センター研究所血管生理学部)
肺高血圧症病態における炎症性シグナルの役割
研究要旨
肺高血圧症病態における炎症性シグナルの役割~基礎研究~
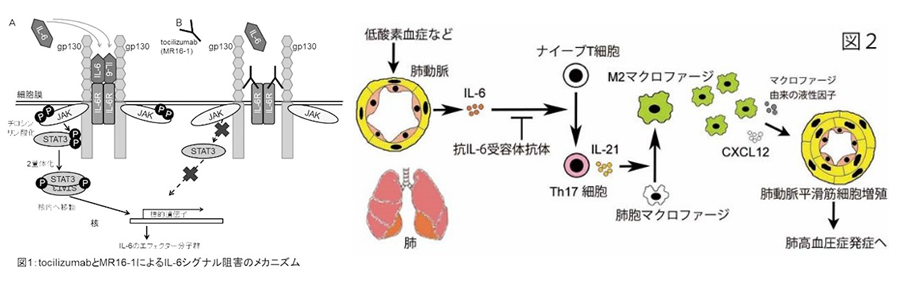
われわれは低酸素(Hx)性肺高血圧症(HPH)マウスで抗interleukin-6(IL-6)受容体抗体tocilizumab(TCZ)のマウス版MR16-1の効果を検討し(図1)、MR16-1がHPH病態を抑制することを見出した(Proc Natl Acad Sci USA 2015;112:E2677-86)。HPHでのIL-6下流シグナルを解析すると、Hx負荷にて肺動脈内皮で誘導されるIL-6は肺でTh17細胞を増加させ、Th17細胞由来のIL-21が肺のマクロファージをM2マクロファージに極性化してHPH病態を促進していた。肺移植レシピエント肺でIL-21とM2マーカーFizz1の発現亢進が見られ、ヒトPHでもIL-6/Th17/IL-21シグナルは重要であることを報告した(図2:Proc Natl Acad Sci USA 2015;112:E2677-86)。
最重症のPHモデルはSugen5416(Su)/Hxラットで、叢状病変などの重症病理像を呈する(Circulation. 2010;121:2747-54)。Su/Hxモデルが重症PHを呈すのは、SuのVEGFR2阻害作用と低酸素(Hx)負荷の組み合わせで肺動脈内皮に過剰な負荷がかかり、アポトーシス耐性細胞が選択されて過剰増殖が誘導され、肺小動脈狭窄・閉塞が生じるためとされていた(Am J Physiol Lung Cell Mol Physiol 2012;302:L977-91)。
われわれはSu/Hxラット肺の遺伝子発現解析で上位にCyp1a1やAhrrを見出し、転写因子Aryl hydrocarbon receptor(AHR:ダイオキシン受容体)の標的遺伝子であることに気づいた。AHRは①毒物の解毒に関わるCYP1A1等の転写誘導、②Th17/Treg制御に関わる、VEGFR2阻害活性のないAHRアゴニストFICZをSDラットに投与してHx負荷3週間と正酸素負荷を順次行うFICZ/Hxモデルで、叢状病変を伴う重症病態が誘導された。一方、AHRアゴニスト活性のないVEGFR2阻害薬投与とHx負荷を組み合わせた負荷ではPAHは誘導されなかった。以上より、ラットのPAH重症化にVEGFR2阻害は関係しないことが分かった。また上記2つの重症PAHモデルにAHR欠損ラットは抵抗性を示した。以上より、Su/Hxモデル病態形成にAHRは必須であることが明らかになった(図3)(Proc Natl Acad Sci USA 2021;118:e 2023899118)
青黛は潰瘍性大腸炎(UC)に有効で治験が進行中であったが(Gastroenterology. 2018;154:935-947.)、青黛を服用するUC患者にPAH発症が報告された(Eur Heart J. 2016;37:1992.)。青黛にはAHRアゴニストのindirubin等が含まれる為、我々はラットに青黛混餌飼料を投与してHxと正酸素を順次負荷した。青黛のPAH増強効果が野生型で見られたが、AHRKOでは見られず、AHRは青黛誘発性PAHでも重要であった(図3)。
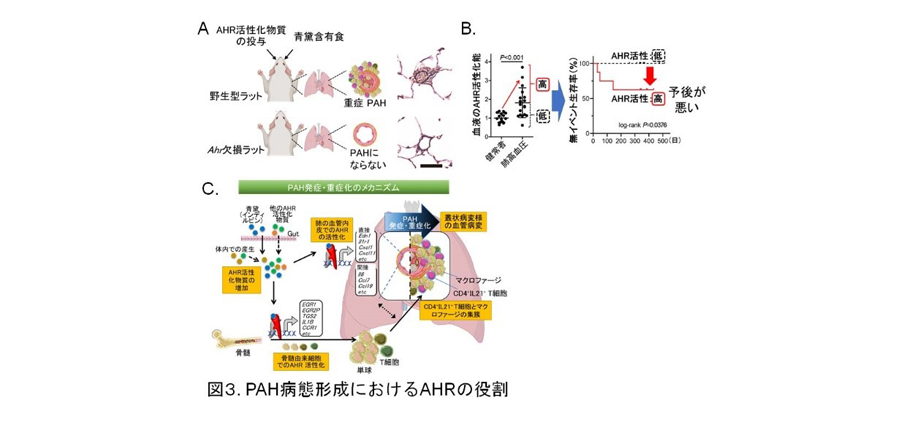
また、PAH患者では健常者に比べて血清AHRアゴニスト活性が有意に上昇し、AHR活性は重症度に相関し、AHR活性の高い群は低い群に比べて死亡・肺移植・入院の発生率が高く、AHR活性は予後と相関した。以上より、AHRはヒトのPAH重症化にも重要であることが明らかとなった(図3:Proc Natl Acad Sci USA 2021;118:e 2023899118)。
高安動脈炎に対するIL-6阻害療法の開発~臨床研究~
高安動脈炎(TAK)は若年女性に多い血管炎で、大動脈と主要分枝の炎症から狭窄・閉塞や拡張・瘤を来す。TAK患者の一部で肺動脈病変によるPHが見られ、PH臨床分類の4群に分類される。治療はステロイド(GC)が第1選択だが、GC単剤では減量過程で再燃が約7割に見られ、GC減量を再燃なく進める治療法が必要であった(Circ J. 2020;84:299-359.)。
われわれは2008~12年にGC抵抗性TAK4症例にtocilizumab(TCZ)によるIL-6阻害療法のパイロット試験を進め、全症例でGC減量が著明に進み、画像上の肥厚退縮が2症例で見られたことを報告した(Int Heart J 2013;54:405-11、Int J Cardiol. 2015;187:319-21.)。以上を踏まえ、GC治療抵抗性TAK症例でのTCZ皮下注製剤による第3相二重盲検の治験(TAKT試験)が2014年に開始された。TAK再発症例にGC増量で寛解を誘導し、TCZ群とプラセボ群に割り付けてGC強制低下での再発迄の期間を比較すると、TCZはプラセボに比べて二重盲検期間での無再発率を59%減少させた(Ann Rheum Dis 2018;77:348-354)。非盲検期間を含めたTCZ投与96週間で、半数の患者が登録時の半量(0.1mg/kg/day)以下にGC減量が進み、健康関連QOLでの改善も見られた(Rheumatology (Oxford). 2020;59:2427-2434.)。以上より、日本では2017年にTCZはTAKで保険適応となり、「血管炎症候群の診療ガイドライン」でGC抵抗性症例にTCZは最上位で推奨されている(Circ J. 2020;84:299-359.)。TAKT試験の画像検査結果を事後解析し、壁肥厚の新規病変出現に注目することでTCZ治療中の再発を早期検出出来ることを最近報告した(Rheumatology (Oxford). 2021 Sep 16: keab684.)。また中岡は「難治性血管炎の医療水準・患者QOL向上に資する厚労省研究班」の大型血管炎臨床分科会長を務め政策医療にも貢献している(Mod Rheumatol. 2021 Nov 27:roab081.13-15、Circ J. 2020;84:1786-1796.、Arthritis Res Ther. 2020;22:72.)。
